Conocimiento previo
Para realizar este proyecto se requiere conocimiento previo de los siguientes temas, si aun no has trabajado con lo que se menciona en la siguiente tabla, allí están los links a los post para que puedas dar un repaso adicional o puedas recordar el conocimiento necesario para poder realizar este proyecto.
| Proyecto | Descripción |
|---|---|
| Fundamentos de electricidad y magnetismo | En este artículo se expondrán los temas de fundamentos de electricidad y magnetismo, donde estudiáremos estos fenómenos físicos para poder entender cada uno de los conceptos básicos. |
Los átomos
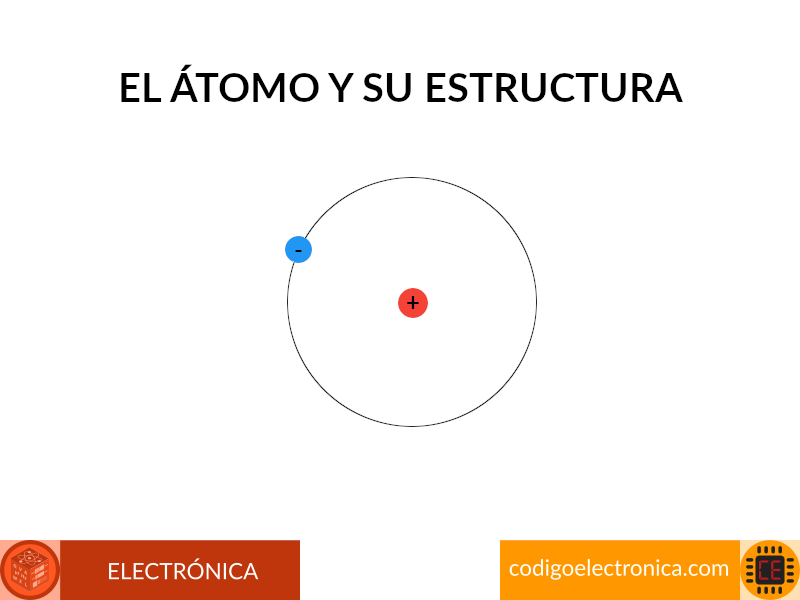
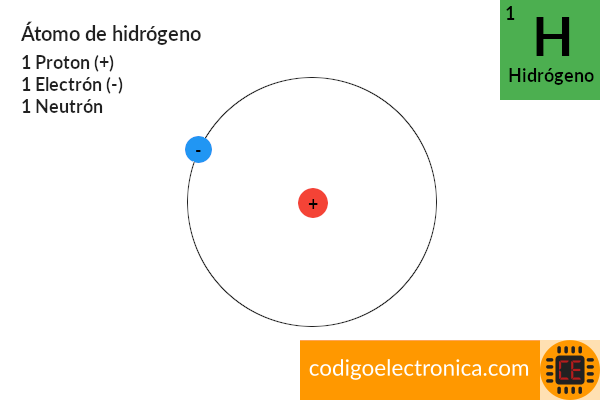
Un conocimiento básico de los conceptos fundamentales de la corriente y el voltaje requiere cierto grado de familiaridad con el átomo y su estructura [1], para entender el átomo analicemos el mas simple que es el de hidrógeno el cual esta formado por dos partículas: el protón y el electrón, donde el núcleo del átomo de hidrógeno es el protón, una partícula cargada positivamente. El electrón que gira alrededor posee una carga negativa de magnitud igual a la carga positiva del protón.
En 1808, el físico y químico británico John Dalton formuló las primeras bases que marcaron el inicio de la era atómica, donde crea la teoría atómica [2] el cual fue el modelo que permitió aclarar por primera vez el porqué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples).
En 1913, Niels Bohr, enunció lo que hoy se conoce como la teoría electrónica y explicó [3], que si fuera posible ver el interior de un átomo, éste sería semejante a un sistema solar en miniatura.
Carga eléctrica del átomo
Cuando decimos que los electrones y los protones tiene carga eléctrica, esto quiere decir que poseen una fuerza la cual ejercen en todas las direcciones y que gracias a ella una partícula tiene el poder de atraer o rechazar otras partículas.
Para que se produzcan cambios eléctricos en los átomos, estos deben estar descompensados o desequilibrados y reciben el nombre de iones. Un ion se forma cuando un átomo gana o pierde uno o varios electrones.
Número atómico
El número atómico es igual al número de protones en el núcleo, el cual es igual al número de electrones en un átomo eléctricamente balanceado (neutro). Por ejemplo, el número atómico del hidrógeno es 1 y el del helio es 2. En su estado normal (o neutro), todos los átomos de un elemento dado tienen el mismo número de electrones que protones: las cargas positivas cancelan las negativas y la carga neta del átomo es cero.
Electrones de valencia
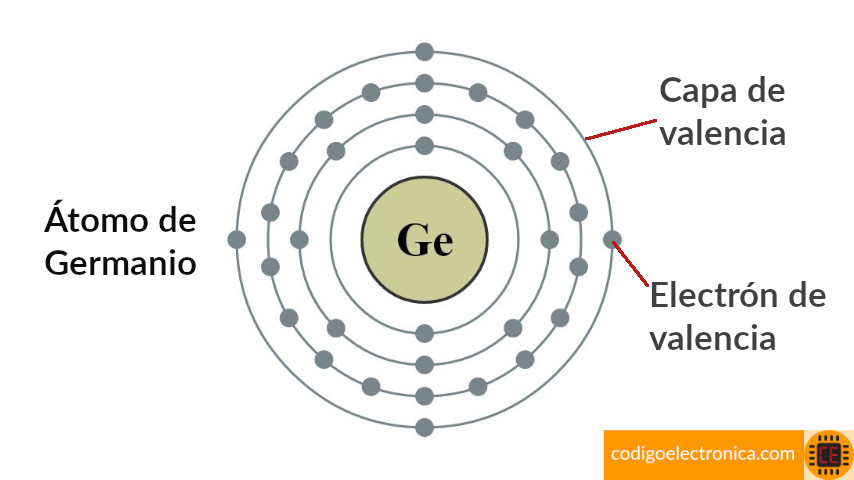
Los electrones que describen órbitas alejadas del núcleo tienen más energía y están flojamente enlazados al átomo que aquellos más cercanos al núcleo. Esto se debe a que la fuerza de atracción entre el núcleo cargado positivamente y el electrón cargado negativamente disminuye con la distancia al núcleo. En la capa más externa de un átomo existen electrones con un alto nivel de energía y están relativamente enlazados al núcleo. Esta capa más externa se conoce como la capa de valencia y los electrones presentes en esta capa se llaman electrones de valencia.
Ionización
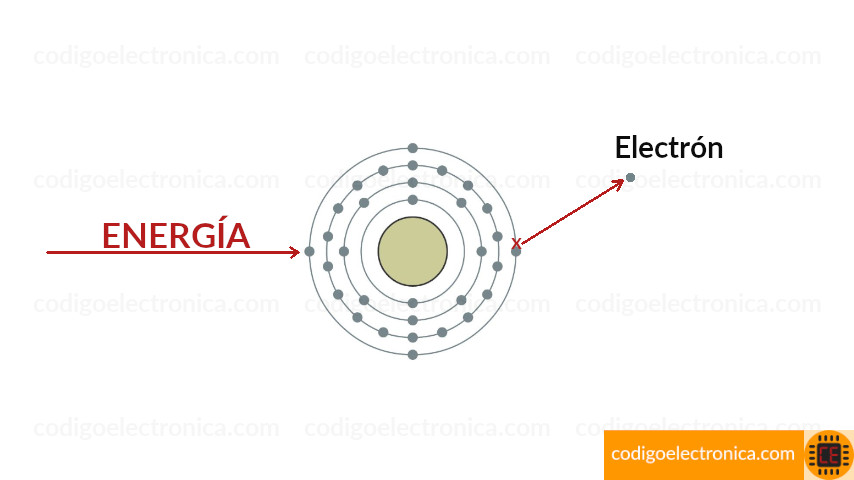
Cuando un átomo absorbe energía de una fuente calorífica o luminosa, por ejemplo, las energías de los electrones se elevan. Los electrones de valencia poseen más energía y están ligeramente enlazados al átomo que los electrones internos, así que pueden saltar con facilidad a órbitas más altas dentro de la capa de valencia cuando el átomo absorbe energía externa.
Si un átomo de valencia adquiere una cantidad suficiente de energía puede escapar con facilidad de la capa externa y la influencia del átomo. La partida de un electrón de valencia deja a un átomo previamente neutro con un exceso de carga positiva (más protones que electrones). El proceso de perder un electrón de valencia se conoce como ionización y el átomo cargado positivamente resultante se conoce como ion positivo.
Ion positivo
Un ion positivo es un átomo o una molécula que ha perdido uno o más electrones, lo que resulta en una carga eléctrica positiva. Esto sucede cuando un átomo neutral pierde electrones durante una reacción química. La pérdida de electrones deja al átomo con un exceso de protones en comparación con los electrones, lo que resulta en una carga positiva neta. Los iones positivos también se conocen comúnmente como cationes. Los cationes son importantes en muchas reacciones químicas y en la formación de compuestos iónicos. Ejemplos comunes de iones positivos incluyen el hidrógeno ionizado (H+), el sodio (Na+), el potasio (K+), el magnesio (Mg2+), etc.
Ion negativo
Un ion negativo es un átomo o una molécula que ha ganado uno o más electrones, lo que resulta en una carga eléctrica negativa. Esto ocurre cuando un átomo neutral captura uno o más electrones durante una reacción química. La adquisición de electrones deja al átomo con un exceso de electrones en comparación con los protones, lo que resulta en una carga negativa neta. Los iones negativos también se conocen comúnmente como aniones. Los aniones son importantes en muchas reacciones químicas y en la formación de compuestos iónicos. Ejemplos comunes de iones negativos incluyen el cloruro (Cl−), el oxígeno (O2−), el sulfato (SO42−), el hidróxido (OH−), etc.
Referencias
[1] Atómos y su estructura, Tomado de introducción al análisis de circuitos paginas (31 - 33), ISBN 970-26-0448-6, Consultado Agosto 2018
[2] Modelo atómico de John Dalton , Tomado de https://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Dalton , Consultado Agosto 2018
[3] Estructura atómica , Tomado de curso electrónica básica paginas (6 -7), Consultado agosto 2018